Образцы составления описания и формулы изобретения
Образцы составления описания и формулы изобретения
1. Способ мультимодального безопиоидного послеоперационного обезболивания у больных с опухолями головы и шеи
Изобретение относится к медицине, а именно к анестезиологии и онкологии, и касается способа обезболивания в послеоперационном периоде.
у онкологических больных.
Высокая травматичность оперативных вмешательств при опухолях в области головы и шеи обусловлена богатой иннервацией и васкуляризацией тканей, близостью рефлексогенных зон, расширенными и комбинированными объемами оперативных вмешательств. Нарушения проходимости дыхательных путей вследствие опухолевого роста, хирургические манипуляции в области верхних дыхательных путей и послеоперационный отек близлежащих тканей сопровождаются выраженными нарушениями дыхания, что обуславливает особые требования к безопасности анальгетиков для послеоперационного обезболивания.
Известен классический способ мультимодального послеоперационного обезболивания, включающий сочетание опиоидных аналгетиков, нестероидных противовоспалительных препаратов (НПВП) и регионарных блокад (Kehlet H. Labat Lecture 2005. Surgical stress and postoperative outcome — from here to where? // Reg. Anesth. Pain Med.-2006.-V.31.-P.47-52).
Недостатками способа являются побочные эффекты опиоидных препаратов – депрессия дыхания, тошнота, рвота, представляющие особый риск для больных с опухолевым поражением головы и шеи (Осипова Н.А., Новиков Г.А., Прохоров Б.М. Хронический болевой синдром в онкологии. — М.: Медицина, — 1998).
Прототипом заявляемого изобретения является способ мультимодального безопиоидного обезболивания с использованием нефопама и НПВП в послеоперационном периоде (Delage N., Maaliki H., Beloeil H. Median effective dose (ED50) of nefopam and ketoprofen in postoperative patients. // Anesthesiology.-2005.-V.102.- P.1211-1216).
Способ заключается в назначении 1% раствора нефопама по 20 мг внутримышечно три раза в сутки и 5% раствора кетопрофена по 100 мг внутримышечно два раза в сутки в течение двух-трех суток после операции.
Недостатком способа является неполный обезболивающий эффект при высокотравматичных операциях в области головы и шеи. Побочные реакции - тахикардия, тошнота, рвота, потливость (Баландин В.В.,Горобец Е.С. Послеоперационное обезболивание нефопамом и НПВП у больных, оперированных по поводу опухолей области головы и шеи. Анестезиология и реаниматология. 2014; 1: 40-43).
Задачей заявляемого изобретения является создание нового, более эффективного способа мультимодального безопиоидного послеоперационного обезболивания больных с опухолями головы и шеи, позволяющего улучшить качество обезболивания и снизить частоту побочных реакций.
Поставленная задача решается применением трехкомпонентной смеси, содержащей 2% раствор лидокаина в объеме 150 мл в сочетании с 1% раствором нефопама в объеме 12 мл и с 1% раствором теноксикама в объеме 4 мл в 134 мл 0,9% физиологического раствора. Смесь вводят внутривенно с помощью одноразовой инфузионной помпы со скоростью 6-8 мл/час в течение от 48 до72 часов после операции.
Техническим результатом, полученным при осуществлении заявляемого способа, является улучшение качества послеоперационного обезболивания и снижение частоты побочных реакций.
Способ осуществляют следующим образом: за 30 мин до окончания операции в 300 мл одноразовую инфузионную помпу набирают трехкомпонентную смесь, состоящую из 2% раствора лидокаина в объеме 150 мл в сочетании с 1% раствором нефопама в объеме 12 мл и с 1% раствором теноксикама в объеме 4 мл в 134 мл 0,9% физиологического раствора, осуществляют инфузию внутривенно со скоростью 6-8 мл/час через периферический или подключичный катетер. Длительность инфузии составляет от 48 до 72 часов после операции.
Для оценки эффективности послеоперационного обезболивания была использована десятибалльная визуально-аналоговая шкала (ВАШ), где 0 баллов – отсутствие боли, 10 баллов – нестерпимая боль. Оценку проводили на следующих этапах исследования: в палате пробуждения и в хирургическом отделении в день операции; далее в хирургическом отделении в течение двух суток после операции.
Изобретение иллюстрируется таблицей и примерами 1 и 2.
На таблице представлена оценка эффективности обезболивания по ВАШ. Выявлено достоверное снижение интенсивности боли у больных, обезболивание которым проводили по заявляемому способу по сравнению с прототипом.
У больных, которым обезболивание проводили по заявляемому способу, в день операции в палате пробуждения и в хирургическом отделении интенсивность боли не превышала 1,06 ± 1 и 2,03 ± 0,6 баллов соответственно. При этом у больных, обезболивание которым проводили по прототипу, интенсивность боли составила 2,0 ± 0,5 и 3,6 ± 0,5 баллов соответственно.
У больных, которым обезболивание проводили по заявляемому способу, на первые и вторые послеоперационные сутки интенсивность боли составила 1,8 ± 0,7 и 1,13 ± 0,5 баллам соответственно. В то время как у больных, обезболивание которым проводили по прототипу, интенсивность боли составила 2,3 ± 0,6 и 1,4 ± 0,3 баллов.
Пример 1. Больной Ш., 72 года, вес – 59 кг. Диагноз: рак слизистой оболочки дна полости рта, метастазы в лимфатические узлы шеи слева.
03.02.2014 г. выполнена операция в объеме сегментарной резекции нижней челюсти слева, фасциально-футлярного иссечения клетчатки шеи слева, резекции дна полости рта с замещением дефекта большой грудной мышцей. Длительность операции составила 5 часов.
Обезболивание начато по заявляемому способу за 30 мин до окончания операции. Скорость инфузии трехкомпонентной смеси составила 6 мл/час при длительности обезболивания 48 часов. Эффективность обезболивания по ВАШ оценена на первые сутки в 2 баллла, на вторые сутки - в 1 балл, что соответствовало низкой интенсивности боли. Побочных реакций во время обезболивания не выявлено.
Пример 2. Больной Д., 47 лет, вес – 66 кг. Диагноз: рак языка, метастазы в лимфатические узлы с двух сторон. 21.05.2014 г. выполнена операция в объеме резекции языка, дна полости рта, краевой резекции нижней челюсти, фасциально-футлярного иссечения клетчатки шеи с двух сторон с замещением дефекта микрососудистым бедреным трансплантатом. Длительность операции составила 11 часов.
Обезболивание начато по заявляемому способу за 30 мин до окончания операции. Скорость инфузии трехкомпонентной смеси составила 8 мл/час при длительности обезболивания 72 часа.
Эффективность обезболивания по ВАШ оценена в первые и вторые сутки после операции в 1 балл. Побочных эффектов во время обезболивания не выявлено.
Обезболивание по заявляемому способу проведено у 41 больного. У всех больных отмечали высокую эффективность обезболивания и снижение частоты побочных реакций в два раза по сравнению с прототипом. Побочные реакции в виде тахикардии и потливости выявлены всего у 2 (4,8%) больных.
Формула изобретения
Способ мультимодального безопиоидного послеоперационного обезболивания у больных с опухолями головы и шеи, включающий применение 1% раствора нефопама в течение 48 -72 часов после операции, отличающийся тем, что раствор нефопама вводят в составе трехкомпонентной смеси, состоящей из 2% раствора лидокаина в объеме 150 мл в сочетании с 1% раствором теноксикама в объеме 4 мл в 134 мл 0,9% физиологического раствора, внутривенно с помощью одноразовой инфузионной помпы со скоростью 6-8 мл/час.
Реферат
Способ мультимодального безопиоидного послеоперационного обезболивания у больных с опухолями головы и шеи.
Изобретение относится к медицине, а именно к анестезиологии и онкологии, и касается способа обезболивания в послеоперационном периоде у онкологических больных.
Способ осуществляют следующим образом: за 30 мин до окончания операции в 300 мл одноразовую инфузионную помпу набирают трехкомпонентную смесь, состоящую из 2% раствора лидокаина в объеме 150 мл в сочетании с 1% раствором нефопама в объеме 12 мл и с 1% раствором теноксикама в объеме 4 мл в 134 мл 0,9% физиологического раствора, осуществляют инфузию внутривенно со скоростью 6-8 мл/час через периферический или подключичный катетер. Длительность инфузии составляет от 48 до 72 часов после операции.
Заявляемый способ улучшает качество послеоперационного обезболивания и снижает частоту побочных реакций.
2. N-Гликозиды индоло[2,3-а]пирроло[3,4-c]карбазолов, обладающие цитотоксической и противоопухолевой активностью
N-Гликозиды индоло[2,3-а]пирроло[3,4-c]карбазолов, обладающие цитотоксической и противоопухолевой активностью
Изобретение относится к области фармацевтической химии и касается новых производных индолопирролокарбазолов, обладающих противоопухолевой активностью.
Известны производные N-гликозидов индоло[2,3-а]карбазолов, обладающие высокой противоопухолевой активностью. К их числу относятся природный антибиотик ребеккамицин [патенты США 4.487.925, 4.552.842], его модифицированный аналог [патент США 4.785.085], а также соединение NB-506 [Tomoko Yoshinari, Mami Matsumoto, at al.,Cancer Res., 1995, 55, p.1310-1315; Hiroharu Arakawa, Tomoko Iguchi, at al.,Cancer Res., 1995, 55, p.1316-1320] и эдотекарин [WO 096/04293 и WO 097/09339]. Структура этих соединений представляет собой малеимид индоло[2,3-а]карбазола, в котором один из индольных атомов азота связан с остатком моносахарида гликозидной связью.
Недостатками вышеперечисленных аналогов являются высокая токсичность, низкая растворимость соединений.
Наиболее близкими к заявляемым соединениям являются соединения N-гликозиды индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов [патент РФ № 2427585] (прототип).
Недостатками соединений являются высокая токсичность при применении относительно невысоких доз соединений, кратковременный эффект.
Задачей изобретения является получение новых соединений этого ряда, обладающих противоопухолевой активностью, пролонгированным действием, меньшей токсичностью при применении более высоких доз соединений.
Заявляемые соединения содержат различные заместители по имидному атому азота в сочетании с различными углеводными фрагментами общей формулы I:
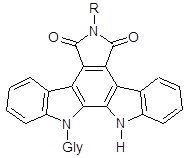
где Gly – остатки пентоз и гексоз,
R - представляет амино-группу, бензамидогруппу, (пирид-2-ил)аминогруппу, ацетамидогруппу или карбамидогруппу.
Для получения заявляемых соединений в качестве исходных соединений были использованы N-гликозиды индоло[2,3-а]фурано[3,4-с]карбазол-5,7-дионов [патент РФ № 2427585] и 6-амино-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов, полученные при обработке ацетилированных гликозидов индолофуранокарбазолов гидразин-гидратом при температуре 50° С в течение 2 часов.
Технический результат заявляемого изобретения состоит в получении новых соединений, обладающих противоопухолевой активностью с пролонгированным эффектом, меньшей токсичностью при применении более высоких доз соединений на более широкой панели опухолей.
Заявляемые соединения охарактеризованы данными спектров 1Н-ЯМР и масс-спектров высокого разрешения. Спектры 1Н-ЯМР записаны на приборе Bruker DRX-500 с программным обеспечением, внутренний стандарт – тетраметилсилан, химические сдвиги d приведены в миллионных долях (м.д.). При описании формы сигналов приведены следующие сокращения: с – синглет, д – дублет, т – триплет, м – мультиплет, дд – дублет дублетов, уш. с. – уширенный синглет; значения констант спин-спинового взаимодействия J приведены в герцах. Масс-спектры зарегистрированы на масс-спектрометре Finnigan MAT 8430 с системой обработки данных SS-300 при ускоряющем напряжении 3 кВ, энергии ионизирующих электронов 70 эВ, температуре источника ионов 250ºС, температуре испарения образца 170-250ºС, с применением системы прямого ввода вещества в область ионизации. Приведены значения m/z (отношение массы частиц к заряду). Аналитическую тонкослойную хроматографию (ТСХ) проводили на силуфоле.
Получение заявляемых соединений иллюстрируется примерами 1-6.
Пример 1
Получение 6-амино-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (1).
К 0,55 г (0.9 ммоль) 13-формил-12-(2,3,4-три-О-ацетил- α - L-арабинопиранозил) индоло[2,3-а]фурано[3,4-с]карбазол-5,7-диона добавляли 3.2 мл (65.25 ммоль) гидразин-гидрата, смесь выдерживали при температуре 50°С в течение двух часов, охлаждали до температуры 22°С, выливали в воду. Выпавший осадок отфильтровывали, промывали 10% спиртом. Выход 6-амино-12-(α-L-арабино-пиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона составил 0.37 г (89%). Масс-спектр: М+ 457 m/z.
1Н-ЯМР (DMSO-d6, δ м.д.): 12.15 (с, 1Н, NH-индол ), 9.23 (д, 1Н, Ar), 9.14 (д, 1Н, Ar), 7.94 (д, 1Н, Ar), 7.70 (д, 1Н, Ar), 7.62 (т, 1Н, Ar), 7.59 (т, 1Н, Ar), 7.41 (т, 1Н, Ar), 7,37(т, 1Н, Ar ), 6.11 (д, 1Н, Н1', J1'2' 9.1), 6.86, 5.38, 5.24 (3 уш с, 3Н, 2',3',4'-ОН), 4.99 (2Н, с, NH2), 4.20-4.05 (м, 3Н, Н2', Н3', Н5''), 4.25 (м, 1Н, Н5'), 3.85 (м, 1Н, Н4').
Пример 2
Получение 6-амино-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (2).
Пирролокарбазол (2) получали из 13-формил-12-(2,3,4,6-тетра-О-ацетил- β-D-галактопиранозил) индоло[2,3-а]фурано[3,4-с]карбазол-5,7-диона аналогично способу получения соединения (1). Выход 6-амино-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона 80%. Масс-спектр: М+ 502 m/z.
1Н-ЯМР (DMSO-d6, δ м.д.): 12.17 (с, 1Н, NH-индол), 9.23 (д, 1Н, Ar), 9.13 (д, 1Н, Ar), 7.96 (д, 1Н, Ar), 7.70 (д, 1Н, Ar), 7.62 (т, 1Н, Ar), 7.59 (т, 1Н, Ar), 7.40 (м, 1Н, Ar), 7,36 (т, 1Н, Ar ), 6.19 (д, 1Н, Н1', J1'2' 9.2), 6.84, 5.36, 5.22, 4.85 (4 уш с, 4Н, 2',3',4',6'-ОН), 4.99 (2Н, с, NH2), 4.25 (м, 1Н, Н2'), 4.17-4.12 (м, 2Н, Н4', Н5'), 3.86 (м, 1Н, Н3'), 3.73 (м, 1Н, Н6''a), 3.66 (м, 1Н, Н6''b).
Пример 3
Получение 6-ацетамидо-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (3).
К смеси, состоящей из 2.5 мл метанола и 5.0 мл тетрагидрофурана, добавляли 56 мг (0.12 ммоль) 6-амино-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона, затем 0.2 мл (0.002 ммоль) уксусного ангидрида. Реакционную массу перемешивали в течение 4 часов при температуре 22°С, затем добавляли 4.0 мл 50% водного метанола. Смесь выдерживали в течение 30 минут, упаривали досуха, добавляли 5.0 мл воды. Образовавшийся осадок отфильтровывали и с помощью препаративной хроматографии на силикагеле в системе бензол-ацетон в соотношении 5:6 из зоны с Rf 0.5 выделяли 31 мг соединения. Выход 6-ацетамидо-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона составил 55%. Масс-спектр: М+ 514 m/z
1Н-ЯМР (DMSO-d6, δ м.д.): 12.24 (д, 1Н, NH-индол), 10.72 (д, 1Н, NHAc), 9.12 (д, 1Н, Ar), 9.06 (д, 1Н, Ar), 8.02 (д, 1Н, Ar), 7.74 (д, 1Н, Ar), 7.68 (м, 2Н, Ar), 7.40 (м, 2Н, Ar),7.15, 5.67, 5.55 (уш с, м 3Н, 3-ОН), 6.45 (1Н, д, Н1' J1'2' 9.0), 4.2-4.05 (м, 4Н, Н2', Н3', Н5', Н5''), 3.39 (м, 1Н , Н4').
Пример 4
Получение 6-(пиридин-2-иламино)-12-(β-D-рибопиранозил)индоло
[2,3-а]пирроло[3,4-с]карбазол-5,7-диона (4).
К 1,51 г (2.7 ммоль) 12-(2,3,4-три-О-ацетил-β-D-рибопиранозил)индоло[2,3-а]фурано[3,4-с]карбазол-5,7-диона в 30 мл метанола добавляли 0.58г (5.3 ммоль) гидразинопиридина. Далее реакционную смесь кипятили 20 минут. Растворитель упаривали, к остатку добавляли 30 мл воды. Выпавший осадок отфильтровывали, высушивали и получали 1,5 г ацетилированного рибозида 6-(пиридин-2-иламино)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона.
Затем к 1,50 г (2.2 ммоль) полученного ацетилированного рибозида в 50 мл абсолютного метанола добавляли 17,2 мл 0,1 н раствора метилата натрия в метаноле. Реакционную смесь перемешивали при температуре 22°С в течение 15 минут. Выпавший осадок отфильтровывали, промывали горячим ацетоном и высушивали. Выход 6-(пиридин-2-иламино)-12-(β-D-рибопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона составил 1,11 г.(91%). Масс-спектр: М+ 549 m/z.
1Н-ЯМР (DMSO-d6, δ м.д.): 11.72 (с,1Н, NH-индол), 9.36 (с, 1Н, NH-Py), 9.14 (д, 1Н, Ar), 9.06 (д, 1Н, Ar), 8.08-7.35 (м, 8НAr, Py), 6,90-6,66 (м, 2H, Py), 6,27 (д, 1Н, Н'), 5.25-3.85 (м, 5Н, Н2', Н3', Н4', Н5', Н5'').
Пример 5
Получение 6-(бензамидо)-12-(β-D-галактопиранозил)индоло
[2,3-а]пирроло [3,4-с]карбазол-5,7-диона (5).
К 45 мг (0.09 ммоль) 6-амино-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона добавляли 0,05 мл (0.43ммоль) бензоилхлорида. Смесь перемешивали при температуре 22° С в течение двух часов. Раствор упаривали, остаток хроматографировали на силикагеле в системе хлороформ:метанол:тетрагидрофуран в соотношении 4:1:1. Из зоны с Rf 0,53 выделяли 26 мг 6-(бензамидо)-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона. Выход составил 47,7%. Масс-спектр М+ 606 m/z.
1Н-ЯМР (DMSO-d6, δ м.д.): 12.2 (уш. с, 1Н, NH-индол), 9.18 (д, 1Н, Ar), 9.07 (д, 1Н, Ar), 8.06 (д, 1Н, Ar), 8.00 (д, 1Н, Ar), 7.75 (д, 1Н, Ar), 7.70-7.57 (м,7Н, Ar, NH-Bz), 6.22 (д, 1H, Н', J1'2', 7.0), 5.42, 5.28, 4.35, 4.18 (4 уш с, 4Н, 2',3',4',6'-ОН), 4.14 (т, 1Н, Н4'), 3.85 (дд, 1Н, Н2'), 3.76 (м, 1Н, Н5') , 3.67 (дд, 1Н, Н3'), 3.33 (м, 2Н, Н6',Н6'').
Пример 6
Получение 6-(карбамидо)-12-(β-D-ксилопиранозил)индоло
[2,3-а]пирроло [3,4-с]карбазол-5,7-диона (6).
К 100 мг (0.17 ммоль) 12-(2,3,4-три-О-ацетил-β-D-ксилопиранозил)индоло[2,3-а]фурано[3,4-с]карбазол-5,7-диона в 5 мл метанола добавляли 46,5 мг (0.42 ммоль) семикарбазида гидрохлорида и 58,4 мл (0.42 ммоль) триэтиламина. Смесь кипятили 3 часа, растворитель упаривали. К остатку добавляли воду. Образовавшийся осадок отфильтровывали, высушивали. Выход ацетилированного ксилопиранозида 6-(карбамидо)-индоло[2,3-а]пирроло [3,4-с]карбазол-5,7-диона составил 80 мг .
Далее к 80 мг ацетилированного ксилопиранозида (0.125 ммоль) в 2,5 мл абсолютного метанола добавляли 0,6 мл 0,1 н раствора метилата натрия в метаноле. Реакционную смесь перемешивали при температуре 22°С в течение 5 минут. Выпавший осадок отфильтровывали, промывали водой, высушивали и получали 45 мг 6-(карбамидо)-12-(β-D-ксилопиранозил)индоло[2,3-а]пирроло [3,4-с]карбазол-5,7-диона. Выход продукта составил 70 %. Масс-спектр М+ 515 m/z.
1Н-ЯМР (DMSO-d6, δ м.д.): 11.87 (с, 1Н, NH-индол), 9.20 (д,1Н, Ar), 9.12 (д,1Н, Ar), 8.65 (уш c, 1Н, NH), 8.04 (д,1Н, Ar), 7.97(с,1Н, NH), 7.81(д,1H, Ar ), 7.62-7.57 (т ,1H, Ar), 6,42 (2Н, с NH2), 6.40(2Н, д, Н1'), 5.40-3.30 (м, 5Н, Н2', Н3', Н4', Н5', Н5'').
Исследование цитотоксической активности соединений (1 – 6) in vitro
Исследование цитотоксической активности соединений (1–6) проводили на клетках рака толстой кишки человека линии НСТ-116:
6-амино-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона, (1);
6-амино-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона, (2);
6-(ацетамидо)-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона, (3);
6-(пиридин-2-иламино)-12-(β-D-рибопиранозил)индоло[2,3-а]пирроло-[3,4-c]карбазол-5,7-диона, (4);
6-(бензамидо)-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло-[3,4-c]карбазол-5,7-диона, (5);
6-(карбимидо)-12-(β-ксилопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона, (6);
Опухолевые клетки выращивали на среде RPMI 1640, содержащей 10% эмбриональной сыворотки теленка, при 5% содержании СО2 и температуре 370С. Цитотоксическую активность соединений (1–6) оценивали по выживаемости клеток, которую определяли с помощью стандартного МТТ-теста с использованием МТТ-реагента (3,4,5-диметилтиазол-2-ил-2,5-дифенилтетразолиум бромид), основанного на способности дегидрогеназ живых метаболически активных клеток восстанавливать МТТ-реагент до голубых нерастворимых кристаллов формазана [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, 2005, М., с 649-651].
Исследования выполняли на 96-луночных микропланшетах. Опухолевые клетки рассевали в 180 мкл культуральной среды и выращивали в течение 24 час. Затем добавляли соединения (1–6) в концентрациях от 0,01 до 100 мкМ в объеме 20 мкл. Время инкубации соединений (1-6) с клетками опухолевых линий составляло 48 час. Контролем служили образцы клеток, к которым соединения (1–6) не добавляли. Через 48 час к клеткам добавляли МТТ-реагент в конечной концентрации 0,5 мкг/мл и инкубировали в течение 2 час. Выпавшие кристаллы формазана растворяли в 100 мкл диметилсульфоксида (ДМСО) в течение 20 мин при температуре 370 С. Далее оптическое поглощение окрашенных растворов измеряли на счетчике оптического поглощения при длине волны 540 нм. При этом оптическое поглощение растворенного в ДМСО формазана коррелировало с количеством оставшихся живых клеток в пробе. Выживаемость клеток для каждой концентрации соединений (1–6) определяли по формуле в (%):
(По /ПК) х 100,
где По – оптическое поглощение растворенного в ДМСО формазана в опытных образцах, ПК – оптическое поглощение растворенного в ДМСО формазана в контрольных образцах.
На основании полученной кривой «доза-эффект» вычисляли значение ингибирующей концентрации (IC50, мкМ) соединения, при которой поглощение формазана в опытных образцах составляло 50% от контрольных образцов. Соединение считали активным, если IC50 была равна или менее 50 мкМ. Ошибка измерений в экспериментах не превышала 5%.
Наиболее высокой цитотоксической активностью обладало соединение (1), при этом IC50 составило 0,5 мкМ, что послужило основанием изучить цитотоксическую активность соединения (1) на других клеточных линиях рака человека.
Соединение (1) было изучено на клетках меланомы МеWo, рака яичников SKOV3, рака предстательной железы DU 145, рака толстой кишки LS174Т, рака молочной железы MCF-7.
Изобретение иллюстрируется таблицами 1 – 4.
В табл. 1 представлена цитотоксическая активность соединений (1- 6) на линии клеток рака толстой кишки человека HCT-116. Показано, что наибольшей цитотоксической активностью обладало соединение (1), при этом IC50 составило 0,5 мкМ.
В табл.2 представлена цитотоксическая активность соединения (1) на меланоме МеWo, раке яичников SKOV3, раке предстательной железы DU 145, раке толстой кишки LS174Т, раке молочной железы MCF-7. Выявлена высокая цитотоксическая активность соединения (1) на клеточных линиях рака толстой кишки LS174 T и рака яичников SKOV3 , при этом IC50 составила 0,8 мкМ. Цитотоксическая активность на клеточных линиях рака предстательной железы DU 145, меланомы МеWo и рака молочной железы MCF-7 была ниже и показатели IC50 составляли 1,8 мкМ, 2,6 мкМ и 10 мкМ, соответственно.
Соединение (1), обладающее максимально выраженной цитотоксической активностью, было изучено in vivo на перевиваемых опухолях мышей.
Исследование противоопухолевой активности соединения (1) in vivo
Противоопухолевую активность изучали на перевиваемых опухолях мышей линий CBA, BALB/с и мышах гибридах первого поколения BDF1 (C57Bl/6 x DBA/2), массой 18 -25 г, которых получали из отдела экспериментальных животных ФГБУ «РОНЦ им. Н.Н.Блохина» РАМН и содержали в виварии на обычном рационе питания.
Противоопухолевую активность изучали на четырех моделях солидных опухолей мышей: эпидермоидной карциноме легкого Льюис (LLC), меланоме (В-16), раке шейки матки РШМ- 5 (РШМ- 5), аденокарциноме толстой кишки АКАТОЛ (АКАТОЛ) и на трех асцитных опухолях: лимфоцитарной лейкемии Р-388 (Р-388), лимфоидной лейкемии L1210 (L1210), опухоли Эрлиха.
Опухолевые клетки LLC и меланомы В-16 перевивали мышам- гибридам BDF1, РШМ-5 мышам-самкам линии СВА, клетки аденокарциномы толстой кишки АКАТОЛ- мышам линии BALB/с, подкожно в правую подмышечную область по 0,5 мл взвеси опухолевых клеток при разведении 1:10 в среде 199.
Противоопухолевую активность оценивали по торможению роста опухоли (ТРО) и увеличению продолжительности жизни (УПЖ) опытных по сравнению с контрольными мышами.
Опухолевые клетки Р-388, L1210 и опухоли Эрлиха перевивали мышам- гибридам BDF1 внутрибрюшинно по 106 опухолевых клеток в 0,3 мл асцитной жидкости при разведении ее средой 199. Критерием оценки противоопухолевой активности являлось только УПЖ.
Введение соединения (1) начинали через 24 час после перевивки асцитных опухолей и через 48 час после перевивки солидных опухолей, при этом непосредственно перед введением соединение растворяли в ДМСО и разводили физиологическим раствором до 10% концентрации. Соединение (1) вводили ежедневно внутрибрюшинно в течение 5 дней в дозах 10 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг и 100 мг/кг.
Опытные группы при перевивке солидных опухолей состояли из 8 мышей, а при перевивке асцитных опухолей - из 6 мышей. Контрольная группа включала 10-12 мышей.
Для оценки ТРО измеряли три максимальных взаимно перпендикулярных размера опухоли (длина, ширина, высота) у каждой мыши и вычисляли её объем, а затем определяли средний объём опухолей в группе. Измерение объёма опухоли проводили каждые 3 дня, начиная с 1 дня после окончания введения соединения, когда размеры опухолей у мышей контрольной группы были измеримыми.
V (мм3) = L х S х H
ТРО вычисляли по формуле:
ТРО (%) = (V к – Vо)\ Vк x 100, где
Vк – средний объем опухолей в контрольной группе (мм3)
Vо – средний объем опухолей в опытной группе (мм3)
Сравнительную оценку противоопухолевой активности по УПЖ проводили после гибели мышей от опухолевого процесса. Сначала определяли среднюю продолжительность жизни (СПЖ) в днях в опытной и контрольной группах, а затем вычисляли УПЖ по формуле:
УПЖ (%) = (СПЖо - СПЖк)\ СПЖк x 100, где
СПЖк – средняя продолжительность жизни мышей в контрольной группе (дни)
СПЖо – средняя продолжительность жизни мышей в опытной группе (дни)
Минимальными критериями противоопухолевой активности служили: ТРО ≥ 50 % и УПЖ ≥ 25 %.
Статистическую значимость результатов оценивали по критерию Стьюдента-Фишера. Статистически значимой противоопухолевую активность считали при p ≤0,05.
Токсичность соединения оценивали по срокам ранней гибели мышей в опытной по сравнению контрольной группой, состоянию внутренних органов животных (селезенки, легких, наличию метастазов в легких) и изменению массы тела по сравнению с исходной.
В табл. 3 показана зависимость противоопухолевой активности от дозы соединения (1) в диапазоне от 10 мг/кг до 100 мг/кг на LLC. При применении соединения (1) в дозах 75 мг/кг и 100 мг/кг отмечена высокая противоопухолевая активность на следующий день после окончания курса введения: ТРО составило 91% и 90%, соответственно. При этом противоопухолевая активность оставалась статистически значимой в течение 15 дней после введения соединения: при значениях ТРО 53% и 58%, соответственно. Максимально переносимой дозой соединения (1) была доза 100 мг/кг, которая вызвала гибель одной из 8 мышей.
Таким образом, доза 75 мг/кг соединения (1) являлась терапевтической при ежедневном внутрибрюшинном введении в течение 5 дней.
В табл. 4 представлена противоопухолевая активность соединения (1) на других опухолях мышей: меланоме В-16, РШМ-5, АКАТОЛе, Р-388, L-1210, опухоли Эрлиха. Противоопухолевую активность соединения (1) в дозе 75 мг/кг наблюдали непосредственно после окончания его введения на меланоме В-16 и РШМ-5, при этом ТРО составило 91% и 97%, соответственно. Противоопухолевая активность соединения (1) через неделю после окончания его введения снижалась при значении ТРО 58% и 52%, соответственно.
Противоопухолевую активность соединения (1) в дозе 20 мг/кг наблюдали непосредственно после окончания введения на АКАТОЛе. ТРО составило 81% и до 29 дня сохранялось на уровне 56%. При этом УПЖ составило 16%.
Противоопухолевую активность соединения (1) на Р-338, на L-1210 и на опухоли Эрлиха оценивали по УПЖ, которое составило соответственно 91%, 47% и 193%.
Формула изобретения.
N-гликозиды индоло[2,3-а]пирроло[3,4-c]карбазолов, обладающие цитотоксической и противоопухолевой активностью, общей формулы I:
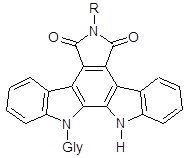
где Gly – остатки пентоз и гексоз, R - амино-группа, бензамидогруппа, (пиридин-2-ил)аминогруппа, ацетамидогруппа или карбамидогруппа,
представляющие собой:
6-амино-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона,
6-амино-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона,
6-(ацетамидо)-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона,
6-(пиридин-2-иламино)-12-(β-D-рибопиранозил)индоло[2,3-а]пирроло-[3,4-c]карбазол-5,7-диона,
6-(бензамидо)-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло-[3,4-c]карбазол-5,7-диона,
6-(карбимидо)-12-(β-ксилопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона.
N-гликозиды индоло[2,3-а]пирроло [3,4-c]карбазолов, обладающие цитотоксической и противоопухолевой активностью.
Реферат
Изобретение относится к области фармацевтической химии и касается новых производных индолопирролокарбазолов, общей формулы I,
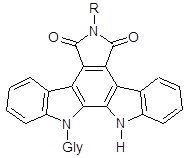
где Gly – остатки пентоз и гексоз, R - представляет амино-группу, бензамидогруппу, (пиридин-2-ил)аминогрупу, ацетамидогруппу или карбамидогруппу. 6-амино-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона, представляющие собой:
6-амино-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона,
6-(ацетамидо)-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона,
6-(пиридин-2-иламино)-12-(β-D-рибопиранозил)индоло[2,3-а]пирроло-[3,4-c]карбазол-5,7-диона,
6-(бензамидо)-12-(β-D-галактопиранозил)индоло[2,3-а]пирроло-[3,4-c]карбазол-5,7-диона,
6-(карбимидо)-12-(β-ксилопиранозил)индоло[2,3-а]пирроло[3,4-c]карбазол-5,7-диона.
Наиболее высокая цитотоксическая активность соединения 6-амино-12-(α-L-арабинопиранозил)индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона выявлена на клеточных линиях рака толстой кишки человека НСТ-116, рака толстой кишки LS174 T и рака яичников SKOV3 , при этом IC50 составила 0,5мкМ и 0,8 мкМ.
Противоопухолевая активность данного соединения изучена на 7 моделях перевиваемых опухолей мышей. Высокая противоопухолевая активность выявлена непосредственно после окончания введения соединения: ТРО на всех моделях опухолей составило от 81% до 97% с пролонгированным эффектом.
Новые производные индолопирролокарбазолов обладают противоопухолевой активностью с пролонгированным эффектом, меньшей токсичностью при применении высоких доз соединений на широкой панели опухолей.
Табл. - 4
3. Протез трахеи для замещения сегментарных дефектов
Изобретение относится к медицине и ветеринарии, а именно к трансплантологии, травматологии, хирургии, онкологии, и касается протезов, предназначенных для замещения сегментарных дефектов трахеи человека и животных.
Известно, что при развитии стеноза трахеи, вызванного злокачественными новообразованиями, инфекционными заболеваниями, послеоперационными осложнениями, ожогами или травмами, возникает необходимость в резекции значительных участков органа. В ряде случаев невозможно формирование первичного анастомоза и возникает необходимость в замещении сегментарных дефектов трахеи протезом.
Известен протез трахеи для восстановления проходимости дыхательных путей (трахеи и бронхов) представляющий собой полый тонкостенный мягкий цилиндр из тканесовместимого эластичного материала с гладкой внутренней поверхностью (патент РФ N 2016557).
Недостатки: тонкостенный цилиндр не имеет жесткоупругих элементов, подобных хрящам трахеи, предотвращающих спадение дыхательных путей при экскурсии легких.
Известны протезы трахеи, состоящие из каркаса, выполненного из материала с памятью формы в виде цилиндрической пружины или объемного тела, поверхность которого образована группами взаимопереплетенных нитей (патенты РФ N 1812980 и N 2000757).
Недостатки: эти протезы обеспечивают свободный просвет, но не создают сплошной мягкотканой стенки трахеи, выполняющей барьерную функцию между полостью воздухоносных путей и внутренней средой организма пациента.
Известен протез трахеи на основе пористой трубки (US 2013158651).
Недостаток: возможность замещения только небольшого по площади окончатого дефекта трахеи.
Известен протез трахеи, представляющий собой клеточный скаффолд с композитной структурой для тканевой инженерии (CN 1386478).
Недостаток: физические свойства материала не позволяют создать сегментарный эндопротез, сходный по механическим и конфигуративным характеристикам с трахеей.
Известен имплантируемый полый протез трахеи, состоящий из жесткоупругого каркаса, покрытого биосовместимой оболочкой из ткани, изготовленной на ткацком станке из поливолокон, например, политетрафторэтилена, образующих полимерную матрицу из нитей и узлов, между которыми имеются единичные пустоты (N 9402475 A1).
Недостатки: протез обладает низкой барьерной функцией, стенка протеза проницаема для крови и воды. Для уменьшения проницаемости стенку протеза покрывают снаружи лекарственным веществом, что может только временно уменьшить риск инфицирования. Возможность плотной фиксации протеза к культе трахеи пациента практически исключена, ввиду использования в основе устройства жесткоупругого каркаса.
Наиболее близким по технической сущности к заявляемому изобретению (прототипом) является протез трахеи для замещения сегментарных дефектов, состоящий из двухслойного пористого (150-250 мкм) полиуретана с поверхностью, модифицированной полиэтиленгликолем (KR 100806677).
Недостатки: жесткость конструкции протеза, оказывающего повреждающее действие на соседние с трахеей ткани и органы, высокий риск развития медиастенита, системных гнойно-септических осложнений, вследствие проницаемости стенки для микроорганизмов через поры полиуретана, неполное соответствие размерам и форме дефектного участка трахеи пациента.
Задачей изобретения является создание протеза трахеи для замещения сегментарных дефектов, соответствующего размерам и форме дефектного участка трахеи пациента, обеспечивающего функциональность органа: осуществление воздухопроводящей и барьерной функций, и быструю фиксацию в тканях после имплантации.
Задача решается тем, что протез трахеи для замещения сегментарных дефектов представляет собой многослойный матрикс тубулярной формы, выполненный из полимерного биосовместимого материала, стенка протеза состоит из 5-6 разнонаправленно ориентированных слоев нетканого ультраволокнистого материала, армирован полукольцами из полиуретана, выполнен с использованием технологии 3D принтинга, а именно электроформования, в соответствии с размерами и формой дефектного участка трахеи пациента, внутренняя и внешняя поверхность протеза модифицирована фибрином сыворотки крови.
Изобретение иллюстрируется фигурами 1-4.
Фиг.1 Схема строения протеза трахеи для замещения сегментарных дефектов. Продольное сечение. (1-технологический слой; 2 -первый внутренний слой; 3-второй внутренний слой; 4- первый наружный слой; 5-второй наружный слой; 6- армирующие полукольца; 7-фибрин).
Фиг.2 Схема строения протеза трахеи для замещения сегментарных дефектов. Поперечное сечение. (1-технологический слой; 2 -первый внутренний слой; 3-второй внутренний слой; 4- первый наружный слой; 5-второй наружный слой; 6- армирующие полукольца; 7-фибрин).
Фиг.3 Протез трахеи для замещения сегментарного дефекта (фото)
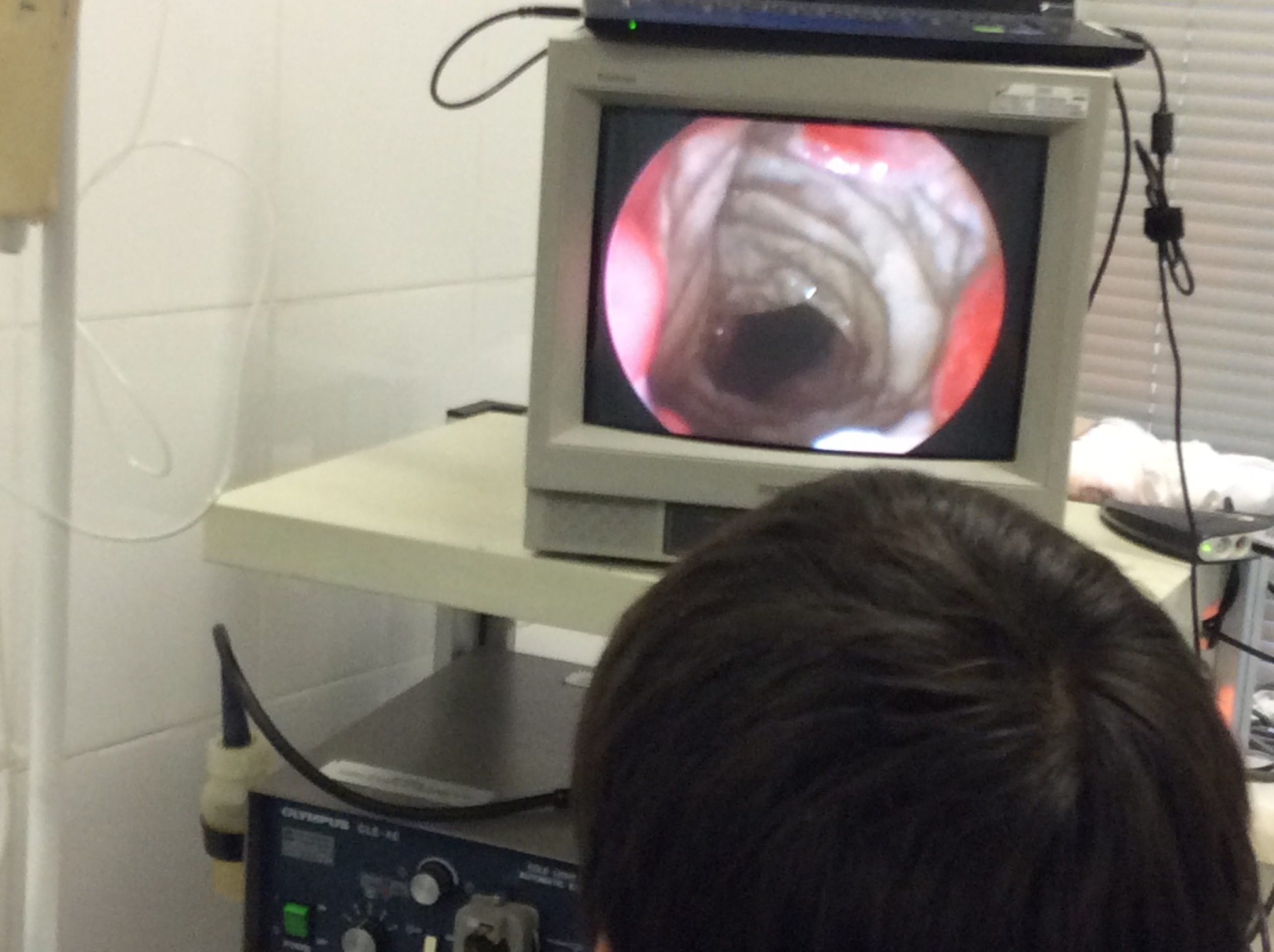
Фиг.4 Замещение дефекта трахеи протезом (трахеоскопия).
Заявляемый протез трахеи представляет собой тубулярной формы матрикс, сформированный из 5-6 разнонаправлено ориентированных слоев биосовместимого ультраволокнистого нетканого ворсистого материала, полученного из фторопласта по технологии электроформования: технологического слоя (1), состоящего из полимерных волокон диаметром 1±0,6 мкм, толщиной ≤0,01 мм; первого внутреннего слоя (2) с диаметром волокон 3,6±3,0 мкм, (плотность упаковки волокон - 10,9±0,6 %); второго внутреннего слоя (3) с диаметром волокон 3,6±3,0 мкм (плотность упаковки волокон - 9,3±1,0 %); первого наружного слоя (4) из волокон диаметром 3,4±3,0 мкм, (плотность упаковки волокон - 10,0±2,0 %), второго наружного слоя (5) из волокон с диаметром 3,5±3,1 мкм (плотность упаковки волокон 7,9±1,0 %).Толщина внутреннего двойного слоя составляет 1,1±0,8 мкм, наружного - 1,2±0,9 мм. Между вторым внутренним и первым наружным слоем с промежутком 4,1±2,5 мм располагаются полукольца из полиуретана (6) толщиной 2,0±1,0 мм, шириной 3,2±3,0 мм, полученные по технологии термопрессования. Для дополнительной фиксации полуколец матрикс прошивают хирургическим шелком и наносят дополнительный защитный слой нетканого материала толщиной 1,2±1,0 мм поверх второго наружного. Внутренний диаметр протеза определяет диаметр осадительного электрода установки для электроформования, а линейный размер – количество нанесенного материала и размах колебаний осадительного электрода относительно центральной оси. После изготовления синтетической основы протеза на внешнюю и внутреннюю поверхности его стенок наносят фибрин (7) сыворотки крови.
Изобретение иллюстрируется следующим примером.
Протез для замещения сегментарного дефекта трахеи собаки породы бигль (возраст 6 лет) изготавливали с использованием электроформования, ориентируясь на форму и размеры дефектного участка трахеи на основании данных компьютерной томографии. Тубулярной формы матрикс формировали из 6 разнонаправлено ориентированных слоев биосовместимого волокнистого нетканого материала, фторопласта Ф-42В. Полукольца, армирующие нетканый полимерный материал, формирующий 6 разнонаправленно ориентированных слоев, изготавливали из полиуретана марки Эластоллан 1195 A. Толщина стенки протеза соответствовала 4 мм. Протез содержал 6 полуколец, шириной 4 мм. Внутренний диаметр протеза – 2,1 см, длина 8,5 см. Полукольца фиксированы между слоями стенок путем прошивания хирургическим шелком. Внешняя и внутренняя поверхности протеза модифицированы фибрином сыворотки венозной крови собаки-реципиента путем осаждения 20% раствором CaCl2 (Фиг.3).
Произведено замещение дефекта трахеи собаки заявляемым протезом. Наблюдение за состоянием собаки осуществляли в течение 1 месяца. Констатировали восстановление функции воздухопроводящих путей без признаков развития гнойно-воспалительных процессов в области имплантации и реакции отторжения протеза. Признаков травматизации соседних органов и тканей не наблюдали. При трахеоскопии в области замещения дефекта протезом наблюдали сформировавшиеся состоятельные анастомозы, сохранение широкого просвета воздухоносных путей, отсутствие признаков развития местного инфекционного процесса (Фиг.4).
Технический результат
Заявляемый протез трахеи обеспечивает замещение сегментарных дефектов с сохранением воздухопроводящей функции, соответствует размерам и форме дефектного участка трахеи пациента, не травмирует соседние органы и ткани, предотвращает возможность инфицирования области средостения. Ворсистая структура нетканой основы значительно увеличивает контактную площадь протеза в области имплантации, что способствует его быстрой фиксации в тканях средостения. Покрытие стенок протеза слоем фибрина дополнительно улучшает цитокондуктивные свойства материала основы, что ускоряет фиксацию протеза в прилежащих тканях и репарацию в области анастомозов.
Формула изобретения
Протез трахеи для замещения сегментарных дефектов, представляющий собой многослойный матрикс тубулярной формы, выполненный из полимерного биосовместимого материала, отличающийся тем, что стенка протеза состоит из 5-6 разнонаправленно ориентированных слоев нетканого ультраволокнистого материала, армирован полукольцами из полиуретана, выполнен с использованием технологии 3D принтинга, а именно электроформования, в соответствии с размерами и формой дефектного участка трахеи пациента, внутренняя и внешняя поверхность протеза модифицирована фибрином сыворотки крови.
Протез трахеи для замещения сегментарных дефектов
РЕФЕРАТ
Изобретение относится к медицине и ветеринарии, а именно к трансплантологии, травматологии, хирургии, онкологии, и касается протезов, предназначенных для замещения сегментарных дефектов трахеи человека и животных.
Заявляемый протез трахеи представляет собой тубулярной формы матрикс, сформированный из 5-6 разнонаправлено ориентированных слоев биосовместимого волокнистого нетканого материала, полученного из фторопласта по технологии 3D принтинга, а именно электроформования. Между вторым внутренним и первым наружным слоем располагают полукольца из полиуретана, полученные по технологии термопрессования. После изготовления синтетической основы протеза внешнюю и внутреннюю поверхности его стенок модифицируют фибрином сыворотки крови.
Заявляемый протез трахеи обеспечивает замещение сегментарных дефектов с сохранением воздухопроводящей функции, соответствует размерам и форме дефектного участка трахеи пациента, не травмирует соседние органы и ткани, предотвращает возможность инфицирования области средостения. Ворсистая структура значительно увеличивает контактную площадь протеза в области имплантации, что способствует его быстрой фиксации в тканях средостения. Покрытие стенок протеза слоем фибрина дополнительно улучшает цитокондуктивные свойства, что ускоряет фиксацию протеза в прилежащих тканях и репарацию в области анастомозов.
Фиг. 1 – 4.
Протез трахеи для замещения сегментарных дефектов

Фиг. 1
Фиг. 2

Фиг. 3
Фиг. 4




